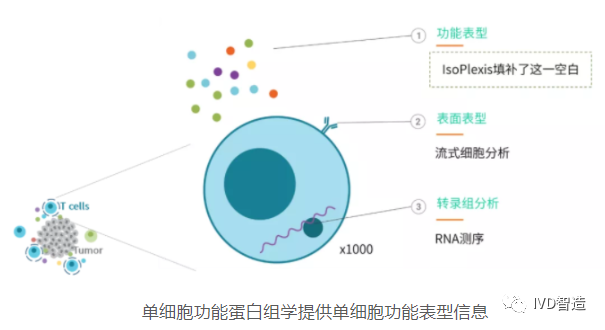
单细胞蛋白质组学分析
细胞是生物体最基本的结构和功能单位,对细胞的精确认知是理解细胞在生理和病理过程中功能的先决条件;
在组织、器官或个体中,细胞具有非常大的异质性,比如肿瘤细胞、免疫细胞、干细胞等,即使是表型完全一致的细胞亚群在功能层面上细胞之间也存在较多差异。而传统的研究手段针对大量细胞进行分析,得到的是大量细胞的平均结果,往往与后期实验结果、筛选目标细胞类群、分析免疫治疗产品效能和预测患者治疗效果等方面的相关性较差,无法区分不同细胞个体对于大量样品结果的具体贡献值,从而忽视或掩盖了单细胞的个体差异,不能完全捕捉细胞的复杂性、多样性以及功能的不同。
因此,开发新技术在单细胞水平揭示细胞异质性,对单细胞技术的需求越来越高。
单细胞功能蛋白质组学技术。主要可以从两个层面来看,
第一个是上面讲的单细胞层面;
第二个是蛋白质层面,目前的单细胞技术包括细胞表型分析,如流式细胞分析技术,基因组层面的单细胞分析,如单细胞基因组、转录组、表观遗传组等。
蛋白质是生命活动的功能直接执行者,不同的细胞决定了组织器官的特异性功能。
单细胞蛋白质组学的目的就是为了实现对单个细胞内蛋白质组成的定性和定量分析,揭示细胞类型及其状态,从而获得不同细胞个体蛋白组的定性和定量差异,构建精细蛋白分子图谱,从根本上揭示不同细胞个体之间的类型及其状态的差异,可以更好地了解细胞及其表型和生命活动。
通过单细胞蛋白质组学分析可以根据差异蛋白质信息来区分不同肿瘤细胞的分子分型,相较于传统的病理组织分析技术更加精细准确,对于理解疾病的发生发展具有重要的意义。
另外,一些生物学样品由于稀少,单细胞技术是唯一可以对其进行研究的技术。例如在胚胎发育早期阶段少量个数的细胞、在神经生物学领域越来越得到重视的单个神经元以及数量稀少的循环肿瘤细胞等,传统蛋白组学技术无法获得这类样品的蛋白质组学数据,因此单细胞蛋白质组将是必要的手段,对于组织亚结构研究、胚胎发育、肿瘤异质性、CTC细胞、干细胞分化和神经研究提供重要的生物学意义。在肿瘤异质性、干细胞分化、生殖细胞发育、循环肿瘤细胞等重要领域有着不可或缺的应用价值。
随着单细胞分析技术发展,多维单细胞组学数据在分析细胞种类和功能层面带给我们更广阔更深入的视角,单个细胞的蛋白质动态变化及细胞功能亚群深入研究,可以帮助我们更好地揭示单细胞层面的精细变化,解析复杂的生物学问题。
目前单细胞蛋白质组学技术主要应用于肿瘤免疫、细胞治疗、炎症、自身免疫性疾病、干细胞、神经系统疾病等领域,随着检测蛋白指标种类的完善和数量的增加,未来将可能应用到越来越广阔的领域。
在CAR-T细胞治疗中,单细胞蛋白组学分析有着非常广泛的应用。它通过对CAR-T细胞在抗肿瘤应答过程中分泌的多种细胞因子进行单细胞维度的分析,从而鉴定出在整个CAR-T细胞群体中真正发挥强大作用的其中一部分CAR-T细胞亚群,亦即可分泌两种或以上细胞因子的细胞,我们称之为多功能细胞,这部分细胞可能只占整个细胞群体的20%,甚至更少,而多项研究证实,这群细胞的存在与CAR-T细胞治疗病人的疗效有着显著相关性。衡量这群多功能细胞效应的指标我们叫做“细胞多功能指数(polyfunctional strength index, PSI)”。
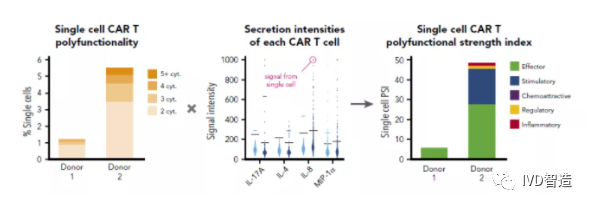
因此,单细胞功能蛋白组学分析平台通过评估免疫细胞应答情况,可用于细胞治疗产品回输病人前的质量评估和疗效预测,在研发中可用于鉴定具有更高功效和更低免疫毒性的细胞治疗产品,从而助力细胞治疗产品的开发,实现更好的精准医疗。
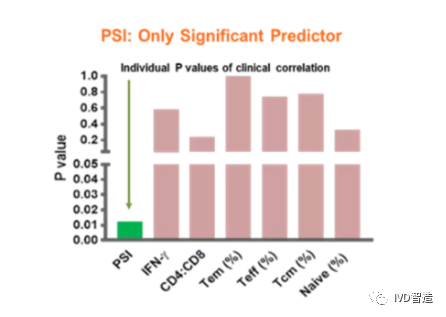
早在2018年,Kite Pharma就在《Blood》上发表了CD19 CAR-T产品治疗非霍奇金淋巴瘤的一期临床试验数据,其中采用单细胞蛋白质组学技术检测到CAR-T细胞产品回输前的PSI与治疗后癌症患者的客观缓解呈统计学显著相关性。研究人员同时也使用了流式细胞分析技术和ELISA检测CAR-T产品的细胞表型和细胞因子分泌情况,但只有单细胞蛋白质组学分析能在这项血液瘤临床试验中区分出该细胞治疗产品的有效者和无效者。
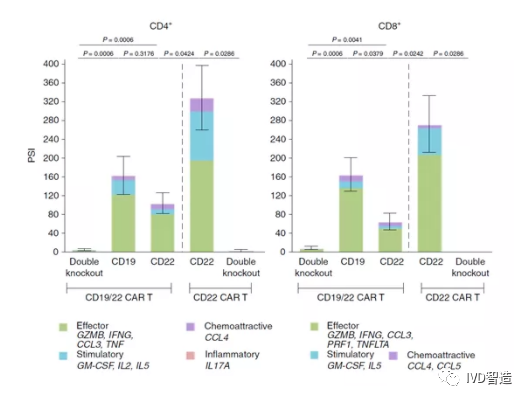
除了CAR-T细胞治疗,在其他类型的细胞治疗中,如TCR-T、TIL、CAR-NK等细胞治疗,单细胞蛋白组学技术也会有越来越多的应用;
单细胞多组学包括细胞层面、基因层面和蛋白层面的单细胞分析,每个维度提供的信息可互相补充,帮助进一步加深对免疫作用机理的探索,推进抗肿瘤研究及治疗开发。
目前在免疫治疗领域,已有多项研究及临床试验数据证实,单细胞蛋白质组学技术可用于免疫相关治疗的体外疗效评估,以及预测病人的临床结局,包括基于PD-1抗体的联合免疫疗法、双特异性抗体、细胞治疗(CAR-T)、肿瘤疫苗开发等。
未来也将会获得更丰富和深入的多组学信息,如转录组水平和蛋白水平之间的调控机制、生物发育和疾病发生机制,为药物开发提供更多依据。
虽然近年来,从系统生物学角度研究基因、蛋白质和代谢物等各种组学研究为发现生命现象的化学基础提供了全新手段。比如时下颇为火热的基因组测序,已经发展到单细胞水平;
但由于蛋白质组的复杂性,单细胞蛋白质组分析要困难得多;
国际上经典的单细胞蛋白质组学研究的方法主要是流式细胞术和化学细胞术两种;
流式细胞术对于揭示疾病的分子信号通路网络具有重要科学价值,在蛋白质水平,流式一直是最为常用的单细胞分析手段。但是由于串色等问题的困扰,流式通常只能进行6~10种蛋白的同时检测。而且蛋白质功能性标记方法非常繁琐复杂、且原代细胞的消耗量大到上百万;
化学细胞术能够成功地在蛋白质表达指纹谱水平甄别细胞间的个体差异性,但蛋白质的鉴定和分离的峰容量无法解决。
单细胞蛋白质组学技术的难点和瓶颈主要在于单细胞内极其微量的蛋白质,一般单个细胞内的蛋白质总量仅不到200 pg,而其又是由上万种不同种类的蛋白质组成,这些蛋白质以极高的动态范围、不同的拷贝数存在于一个单独的细胞中。
直接对这些蛋白质进行组学鉴定分析,在其样品前处理、分离和质谱检测都是一种挑战。因此受到极微量样本制备、超高灵敏度高分辨生物质谱仪等限制,单细胞蛋白质组学分析一直都是“圣杯”一样存在;
目前为解决单细胞极微量样本制备的难点,科学家们开发出来一种体系是基于TMT进行标记的方法。
Scope2研究系统主要是通过TMT的多通道优势,将其中一个通道作为carrier cell通道,一般为20~200个细胞量的样品,其他通道作为单细胞通道。各通道在完成TMT标记后进行混合上机检测。
采用carrier cell通道的优点有如下几点:
第一、可以有效补偿单细胞样品在后续分析中的损失;
第二、其对蛋白质的定性可以使用含量更高的carrier cell通道中的MS/MS,而借助TMT各通道报告离子进行定量;
第三、大大提高单细胞检测的通量。
除此之外,还有研究者采用基于液滴的样品前处理系统,如nanoPOTS、gOAD、nested nanoPOTS(N2) chip和proteoCHIP系统,这类系统主要优点有:
1)液滴体积小可以减少与管壁接触转移带来的样品损失问题;
2)小体积液滴与单细胞样品兼容性更好,具有更高的酶切反应速率。但也有其不足之处,比如该液滴操作系统需要在具备相关操作能力的实验室开展,还需开发适用于液滴体系上样的新技术。
此外,还有一类是结合超高灵敏度质谱仪timsTOF和DIA采集模式,在前处理过程中缩小反应体系到2ul左右以此减少样品损失,实现单细胞的蛋白质组学分析。
这个技术的难度在于如何在单细胞的层面实现多重功能蛋白质的检测,单细胞蛋白检测势必要求比较高的灵敏度,而同时检测多种蛋白则对所使用的捕获抗体和检测抗体提出了更高的要求,以避免产生相互信号干扰。现如今的蛋白检测方法要么在通量上寻求突破,要么在检测灵敏度上追求极限,很难做到二者的兼顾。
另外,如何选择检测蛋白的种类以反映细胞的真实功能也是需要考量的因素,包括细胞在外界刺激下分泌的蛋白及胞内信号通路激活涉及的磷酸化蛋白等。参与生物反应和行为的蛋白种类多达数百种,如何从中选出有代表性的蛋白指标,尽量降低检测成本,同时能综合反应细胞对外界不同刺激条件或药物处理后的反应,需要大量的前期数据积累和反复验证。
最后,基于单细胞蛋白质组学获得的大量生物学信息,如何将它转化为可指导下一步决策的定量指标,获得有意义的数据也是非常重要的。在当今的大数据时代,获得海量数据不再困难,而要从大数据中搜索出有效信息,则是目前面临的一个新挑战。
该技术是一种创新性检测体系,它利用了分泌蛋白质组和胞内蛋白质分析中各种技术的优点。芯片通过结合工程学和物理学突破了目前的分析边界,能够针对大量蛋白质样本进行小体积、高灵敏度的检测,采用独特的通路特异性多重性检测策略,在单细胞分辨率下实现对细胞功能和应答表征的独特见解。
基于抗体—抗原特异性识别的免疫检测技术是生物医学研究、临床诊断及药物开发等领域中应用最广泛的靶向、高灵敏蛋白检测方法。传统的基于96孔板的免疫检测技术存在样品/试剂消耗量大、检测指标单一等缺点。而数字微流控(Digital Microfluidics,以下简称“DMF”)芯片可通过电场驱动实现在二维平面对微升—纳升级液体样本进行精准、自动操控,具有实现微量生物样本自动化检测并升级传统分析平台的潜力。然而,由于光谱重叠等技术限制,目前文献报道的DMF免疫检测平台一般仅能实现同时分析2至3种靶向蛋白,难以满足研究、应用需求。
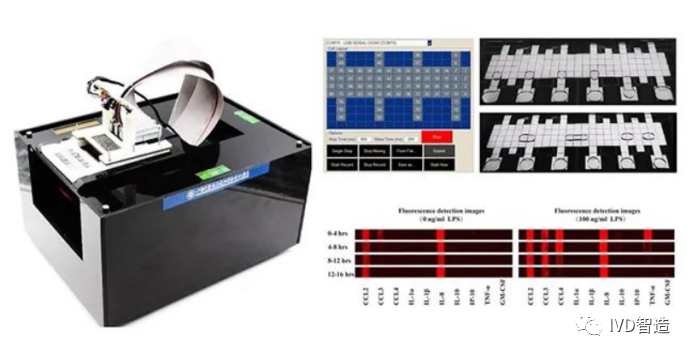
针对上述问题,中国科学院大连化学物理研究所团队通过在DMF平台集成条形码芯片技术,利用位置分辨突破光谱重叠限制,实现了多指标免疫检测:在DMF芯片上极板的疏水层表面构建位置分辨的抗体条形码阵列,用于多指标蛋白检测;在DMF芯片的底板上建立独立驱动电极阵列,实现微量样品、检测试剂等输运,完成反应、染色等免疫检测过程。合作团队最终在同一芯片上利用单色荧光检测,实现了十个样本以及每个样本十种靶向蛋白的同时分析,为目前文献报道的DMF平台免疫检测的最高通量及最多指标,样品消耗量仅为4微升。









 苏公网安备32050502011778号
苏公网安备32050502011778号



