电化学免疫传感器的原理和分类
电化学免疫传感器是以抗原/抗体为特异性分子识别元件,且与电化学传感元件直接接触,并通过传感元件把某种或者某类化学物质的浓度信号转变为相应的电信号的传感器。因其是基于抗原和抗体的特异性反应发展起来的,电化学免疫传感器较其他电化学生物传感器有更高的专一性和选择性。同时,由于它耦联各种电分析技术,如溶出伏安法、脉冲伏安法、脉冲差分法等,大大提高了灵敏度,在短短几十年里,相继开辟了种类繁多的研究领域和应用领域,目前正朝着更加灵敏、特效、微型和适用的方向发展。
一、电化学免疫传感器的原理
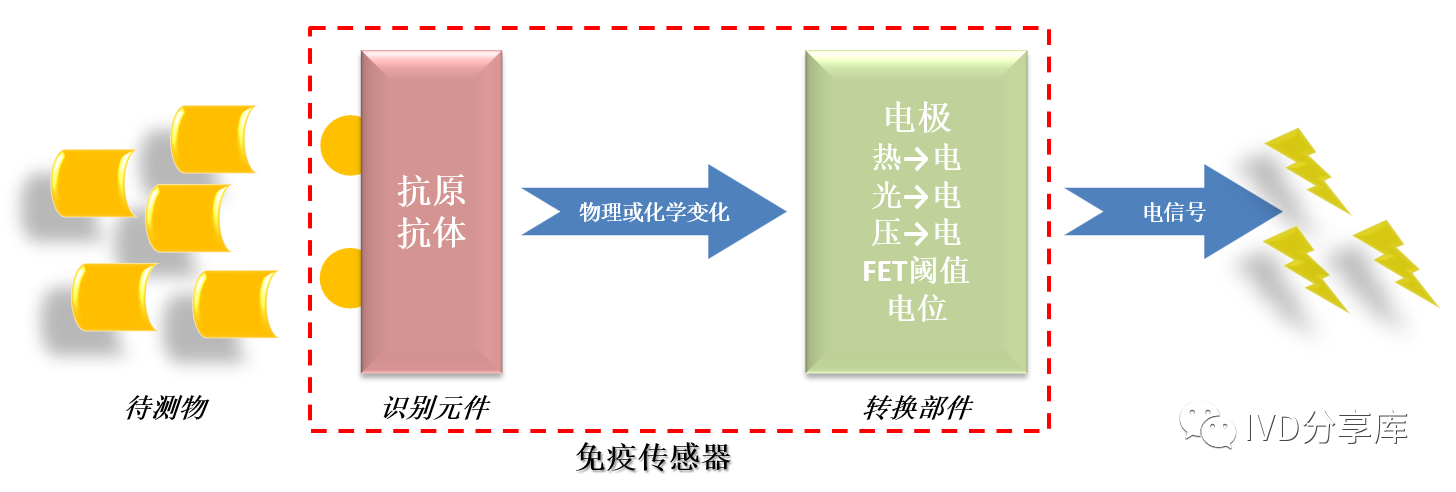
电化学免疫传感器的结构(来源:IVD分享库)
参考文献:
[1]钟桐生,等. 电化学免疫传感器研究进展.化学传感器. 2002,22(1):7-14.
[2]袁若,等. 高灵敏电位型免疫传感器对乙型肝炎表面抗原的诊断技术研究,中国科学B辑化学,2004,34(4):279-286.
[3]缪璐,等. 电化学免疫传感器的研究进展.中国医学物理学杂志,2006,23(2):132-134.
[4]唐点平,等. 纳米金修饰玻碳电极固载抗体电位型白喉类毒素免疫传感器的研究,化学学报,2004,62(20):2062-2066.
[5]Fu Y Z, Yuan R, Fang D P, et al. Study on the immobilization of anti-IgG on Au-colloid modified gold electrode via potentiometric immunosensor, cyclic voltammetry, and electrochemical impedance techniques. Colloids and Surfaces B: Biointerfaces, 2005, 40 (1): 61-66.
[6]Bard A J, Faulkner L. Electrochemical Methods (电化学方法). Gu Linying(谷林瑛)译. Beijing(北京):Chemistry Industry Press (化学工业出版社),1986:9.
[7]Gebbert A, Alvarez-Lcaza M, Stocklein W, et al. Real-time monitoring of immunochemical with a tantalum capacitance flow-through cell. Anal Chem, 1992, 64 (9): 997-1003.
[8]Mencil CJ, Athey D, Rail M, et al. Electrochemical Sensors Based on Impedance Measarement of En-zyme-Catalyzed Polymer Dissolution Theory and Applications. Anal Chem, 1995, 67: 3928.
[9]Bataillard P, Gardies F, Jaffrezic-Renault N, et al. Direct detection of immunospecies byew capacitance measurements. Anal Chem, 1988, 60 (21): 2374-2379.
[10]Park I, Park S, Park HW, et al. Unexpected Hexagonally Perforated Layer Morphology of PS-b-PM-MA Block Copolymer in Supported Thin Film. Macromolecules, 2006, 39 (1): 315-318.
[11]AntoliniF, Paddeu S, Nicolini C, et al. Heat stable langmuir blodgett film of glutathione-s-transferase. Langmuir, 1995, 11: 2719-2725.
[12]Porter MD, Bright TB, Allara DL, et al. Spontaneously organized molecular assemblies 4 Structuralcharacterization of n-alkyl thiol monolayers on gold by optical ellipsometry, infrared spectroscopy, andelectrochemistry. J Am Chem Soc, 1987, 109 (12): 3559-3568.
[13]Park H, Park TJ, Huh YS, et al. Immobilization of genetically engineered fusion proteins on gold-decorated carbon nanotube hybrid films for the fabrication of biosensor platforms Original Research Article. J Colloid Interf Sci, 2010, 350: 453-458.
[14]Zhang XR, LiSG, Jin X, et al. Aptamer Based Photoelectrochemical Cytosensor with Layer-by-Layer Assembly CdSe Semiconductor Nanoparticles as Photoelectrochemically Active Species, Biosens. Bioelectron, 2011, 26: 3674-3678.
[15]Yuan WY,Li CM.Direct Modulation of Localized Surface Plasmon Coupling of Au Nanoparticles on Solid Substrates via Weak Polyelectrolyte-Mediated Layer-by-Layer Self Assembly. Langmuir, 2009,25 (13):7578-7585.
[16]Yamada M, Shiratori SS. Smoke sensor using mass controlled layer-by-layer self-assembly of polyelectrolytes films. Sens Actuators B, 2000, 64: 124-127.
[17]Taylor RF, Marenchic LG, Cook EJ. An acetylcholine receptor-based biosensor for the detection of cholinergic agents. Anal Chim Acta, 1988, 213: 131-138.
[18]Stelzle M, Weissmuller G, Sackmann E. On the application of supported bilayers as receptive layer for biosensors with electrical detection. J Phys Chem, 1993, 97: 2974-2981.
[19]Varlan AR, Suls J, Sansen W, et al. Capacitive sensor for the allatostatin direct immunoassay. Sens Actuators B, 1997, 44(1-3): 334-340.
[20]Taylor RF, Marenchic IG, Spencer RH. Antibody-and receptor-based biosensors for detection and process control. Anal Chim Acta, 1991, 294: 67-70.
[21]Golshan-Shirazi S, Guiochon G. Analytical solution for the ideal model of chromatography in the case of a Langmuir isotherm. Anal Chem, 1988, 60 (21): 2364-2374.









 苏公网安备32050502011778号
苏公网安备32050502011778号



